INTRODUCCION:
La Teoría Atómica se basa en la suposición de que la materia no es continua, sino que está formada por partículas distintas. Esta teoría describe una parte de nuestro mundo material a la que no es posible acceder por observación directa, y permite explicar las propiedades de las diversas sustancias.
El objetivo de este trabajo es presentarles los diversos modelos atómicos que se presentaron a lo largo de estos años, con sus pequeñas falencias, donde cada modelo se apoya en los anteriores, conservando determinados aspectos y modificando otros. Pero antes, daremos a conocer una serie de sucesos y conceptos para el desarrollo de estas teorías y modelos.
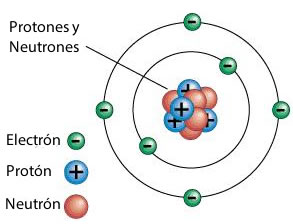
Luego a principios del siglo XX, Ernest Rutherford descubre el protón, que es una partícula elemental que constituye parte del núcleo de cualquier átomo.
Los protones poseen carga eléctrica positiva y una masa 1.836 veces mayor de la de los electrones.
Por otro lado, Walter Bothe y Herbert Becker en 1930 descubre el neutrón, una partícula elemental que constituye parte del núcleo de los átomos.
La masa del neutrón es ligeramente superior a la del protón. Los neutrones carecen de carga eléctrica, y son inestables cuando se hallan fuera del núcleo, desintegrándose para dar un protón, un electrón y un antineutrino.
En el átomo distinguimos dos partes:
El núcleo es la parte central del átomo y contiene partículas con carga positiva (los protones), y partículas que no poseen carga eléctrica, es decir son neutras (los neutrones.
La masa atómica es la masa de un átomo. Aunque la unidad de masa del SI es el kilogramo, la masa atómica a menudo se expresa en la unidad dalton, que no pe unificada.rtenece al SI, equivalente a la unidad de masa atómica.
TIPOS DE MODELOS ATOMICOS:
- Modelo atómico de Demócrito (450 a. C.), el primer modelo atómico, postulado por el filósofo griego Demócrito.
- Modelo atómico de Dalton (1803), que surgió en el contexto de la química, el primero con bases científicas.
- Modelo del átomo cúbico de Lewis (1902), donde los electrones están dispuestos según los vértices de un cubo, que explica la teoría de la valencia.
- Modelo atómico de Thomson (1904), o modelo del pudín, donde los electrones son como las "frutas" dentro de la "masa" positiva.
- Modelo atómico de Rutherford (1911), el primero que distingue entre el núcleo central y una nube de electrones a su alrededor.
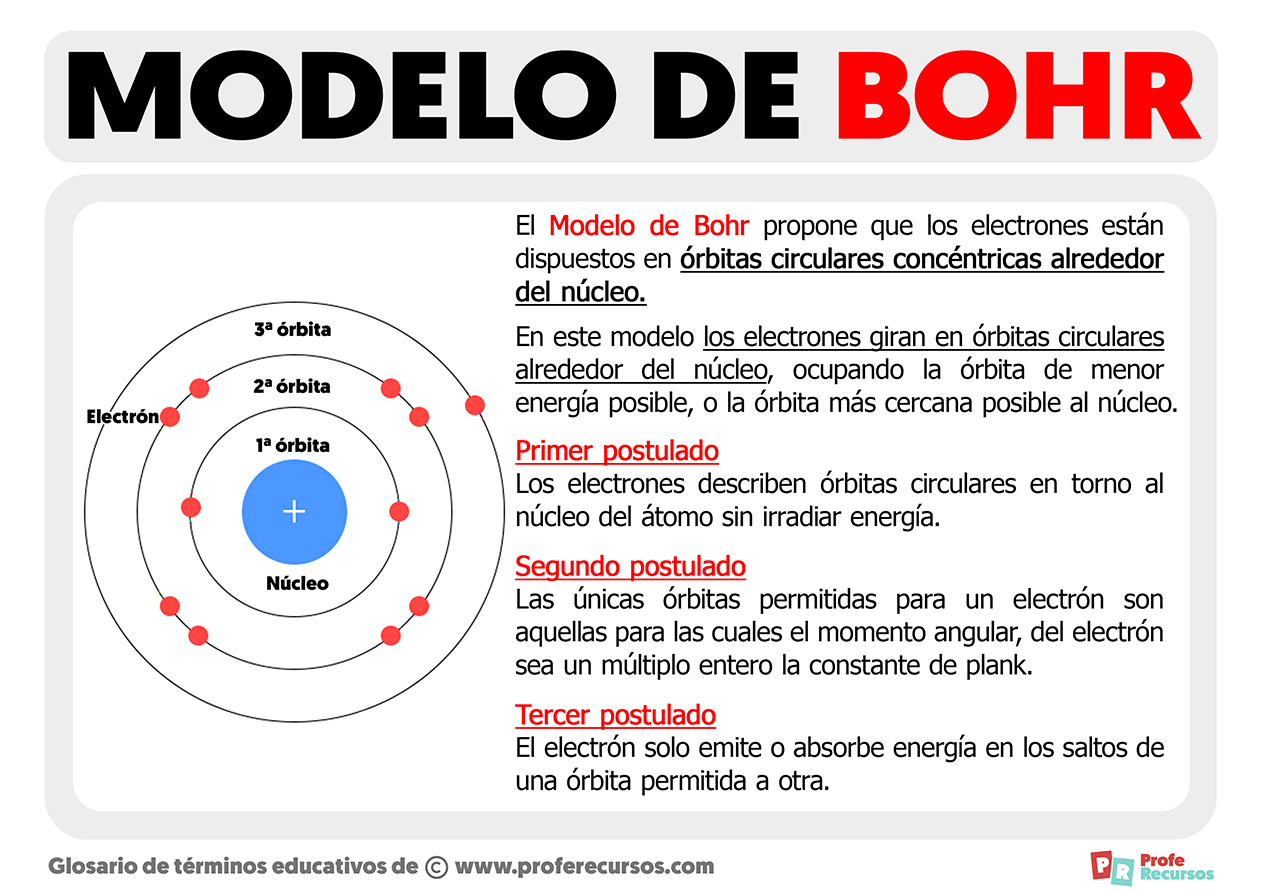
- Modelo atómico de Bohr (1913) en el que los electrones giraban en órbitas circulares.
- Modelo atómico de Sommerfeld (1916), una versión relativista del modelo de Rutherford-Bohr.
- Modelo atómico de Schrödinger (1926), un modelo cuántico no relativista donde los electrones se consideran ondas de materia existente.
- Modelo atómico de Heisenberg (1925),comenzó a desarrollar un sistema de mecánica cuántica, denominado mecánica matricial, en el que la formulación matemática se basaba en las frecuencias y amplitudes de las radiaciones absorbidas y emitidas por el átomo y en los niveles de energía del sistema atómico.
- Modelo atómico de Chadwick (1932), confirmó la existencia de otra partícula subatómica de la que se tenían múltiples sospechas: el neutrón.


No hay comentarios.:
Publicar un comentario